Ida Emilie Steinmark undersöker hur Crispr skulle kunna förändra världen.

Artikel ur The Economist Technology Quarterly Gene Editing, 21 februari 2025, översatt av InPress. ©2025 The Economist Newspaper Limited. Alla rättigheter förbehållna.

Foto: North Carolina State Univ.
I början av 2005 stod Rodolphe Barrangou och Philippe Horvath vid en skärm i Frankrike och stirrade på mycket märkliga bitar av upprepande genetisk kod. Sekvenserna kom från Streptococcus thermophilus, en bakterie som, likt många andra bakterier, ofta går i klinch med virus. Enligt ryktet kunde just dessa DNA-sekvenser ge bakterierna ett övertag. Om det nu var så, då ville forskarna veta allt om saken. S. thermophilus är en av de mikrober som används i yoghurttillverkning. Kunde den skyddas mot virus, då skulle livsmedelstillverkaren Danisco, där forskarna jobbade, spara miljontals euro.
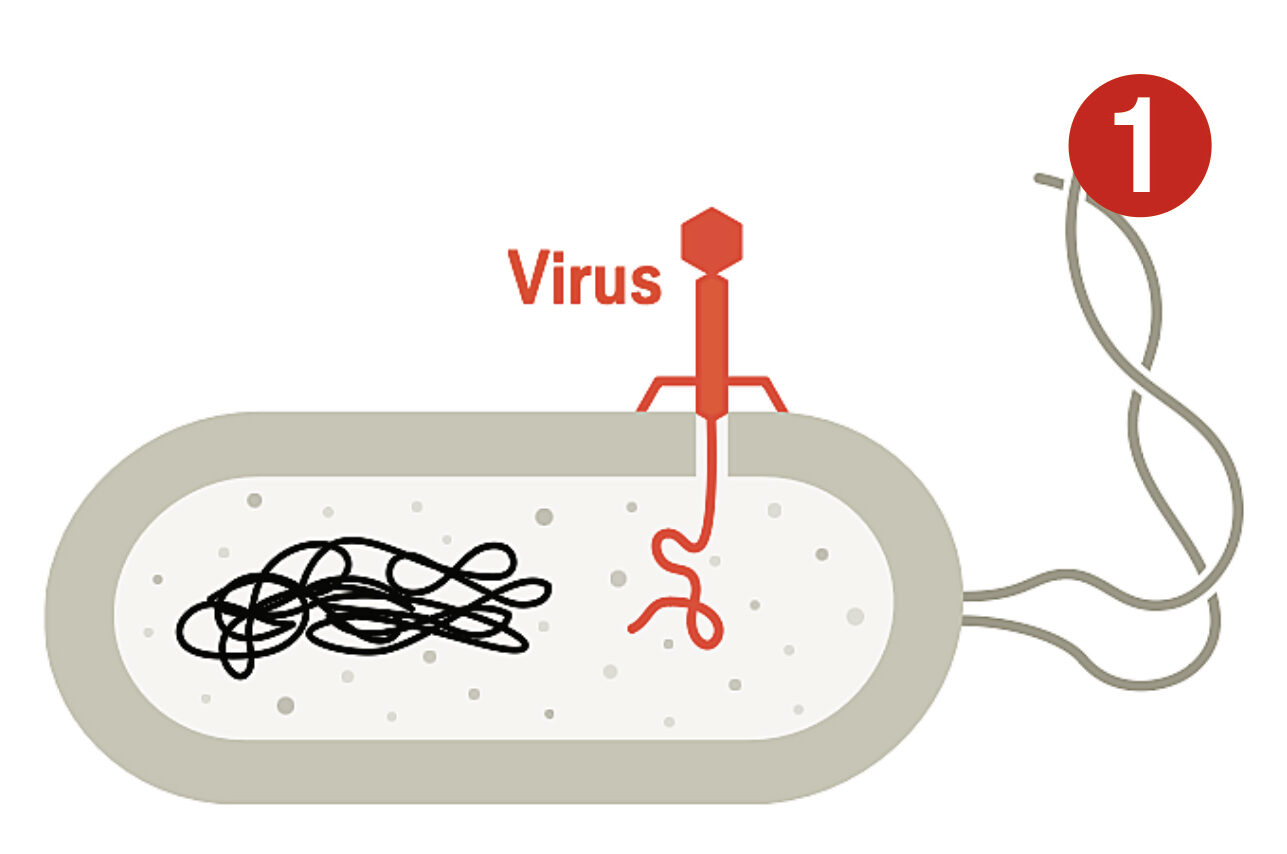
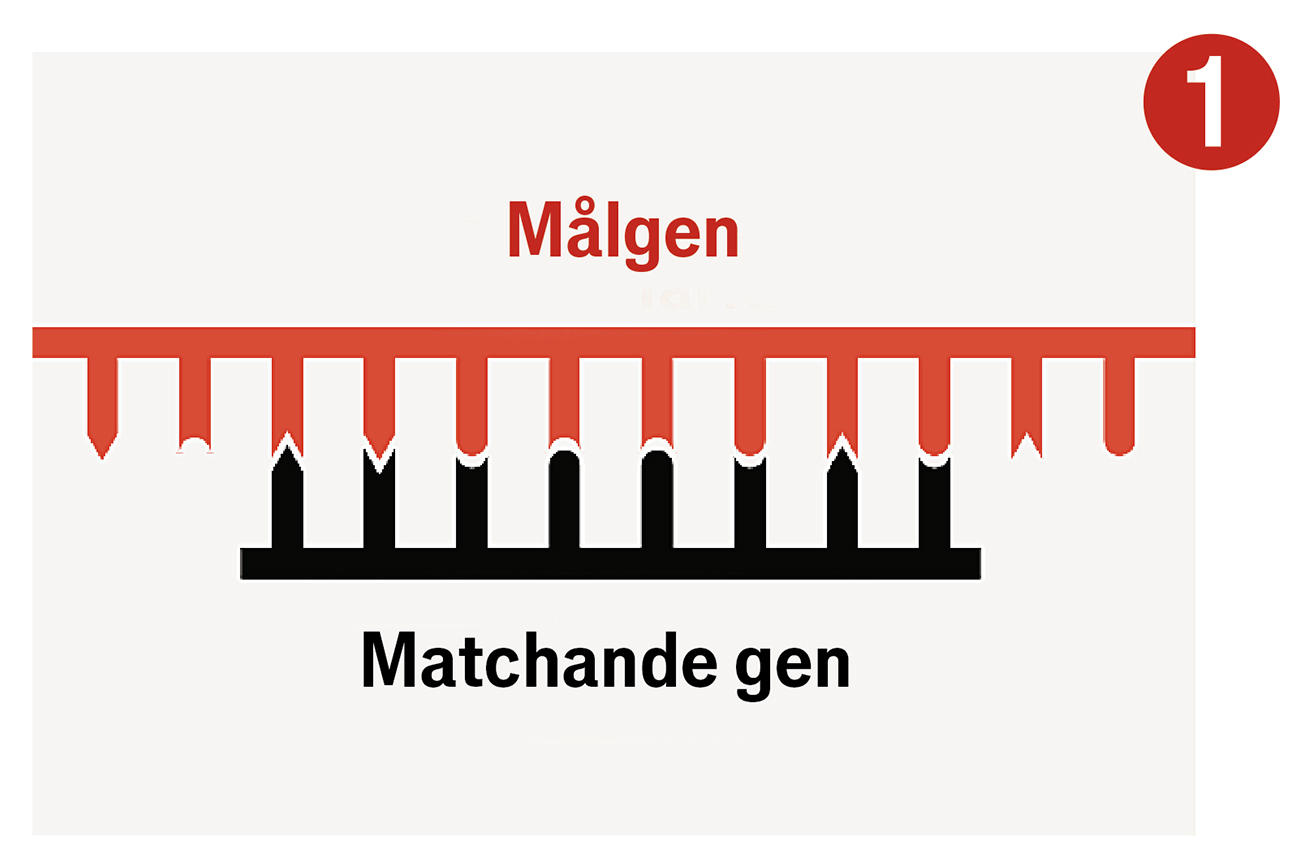
De jämförde de märkliga sekvenserna från olika stammar av S. thermophilus som var resistenta mot olika sorters virus. I samtliga fall var DNA-bitarna mellan de upprepade sekvenserna identiska med DNA från det virus som bakterien blivit resistent mot. Forskarna tog då bitar av DNA från ett specifikt virus och stoppade in dem mellan upprepade sekvenser i en icke-resistent stam. Häpnadsväckande nog blev stammen då immun. Bakterier som överlevde en virusattack verkade behålla bitar av det angripande virusets DNA i sina egna genom. Det fungerade som en varningsmekanism: om samma bit DNA dök upp igen, då visste cellen att den var utsatt för angrepp.

Upptäckten av detta immunsystem hos bakterier var en stor nyhet för mejeribranschen, som plötsligt kunde välja bakterier baserat på önskad immunitet. Sådana bakteriestammar är nu normen hos de flesta yoghurt- och ostproducenter. Ett lyckosamt, kommersiellt resultat av mikrobiologi.

Men 2012 gick Emmanuelle Charpentier vid Max Planck-institutet i Tyskland och Jennifer Doudna vid UC Berkeley betydligt längre med de praktiska resultaten av arbetet. De märkliga upprepningarna, även kallade Clustered, Regularly Interspaced, Short Palindromic Repeats, eller Crispr, kan användas för att göra snitt vid exakta sekvenser i genomet hos vilken organism som helst; jästsvampar, fiskar, grisar och människor.
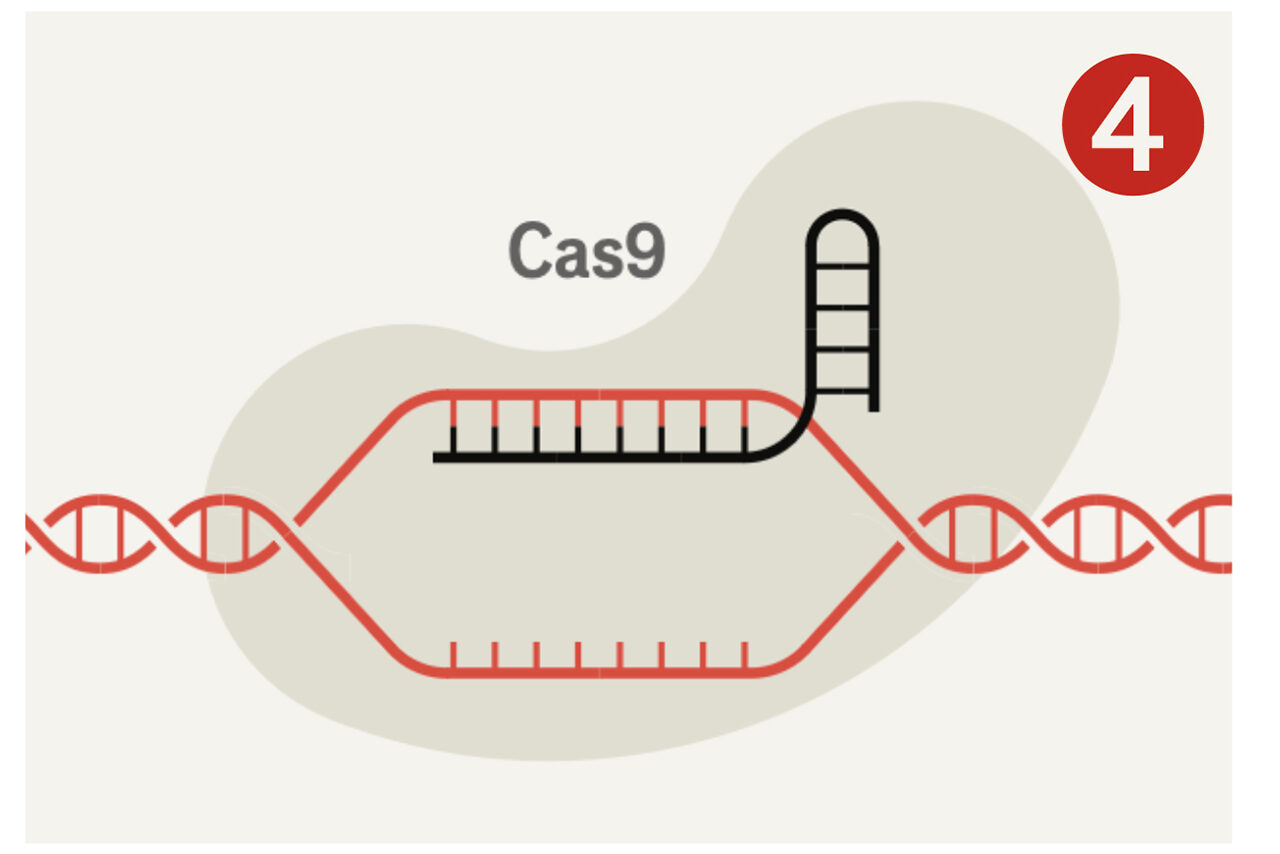
Deras metod gick ut på att få celler att tillverka ett protein som heter Cas9 – ett slags molekylärt verktyg som kan klippa i DNA – tillsammans med en bit Crispr-liknande RNA som visar var klippet ska ske. RNA innehåller, liksom DNA, en serie baspar. Om man vet vilken DNA-sekvens man vill åt, kan man enkelt skapa en matchande RNA-sekvens att fästa i änden av en bit Crispr-RNA, som Cas9 sedan binder till. När RNA och Cas9 hittar rätt ställe i arvsmassan, gör Cas9 ett snitt.
I naturen är CRISPR en del av bakteriers immunsystem
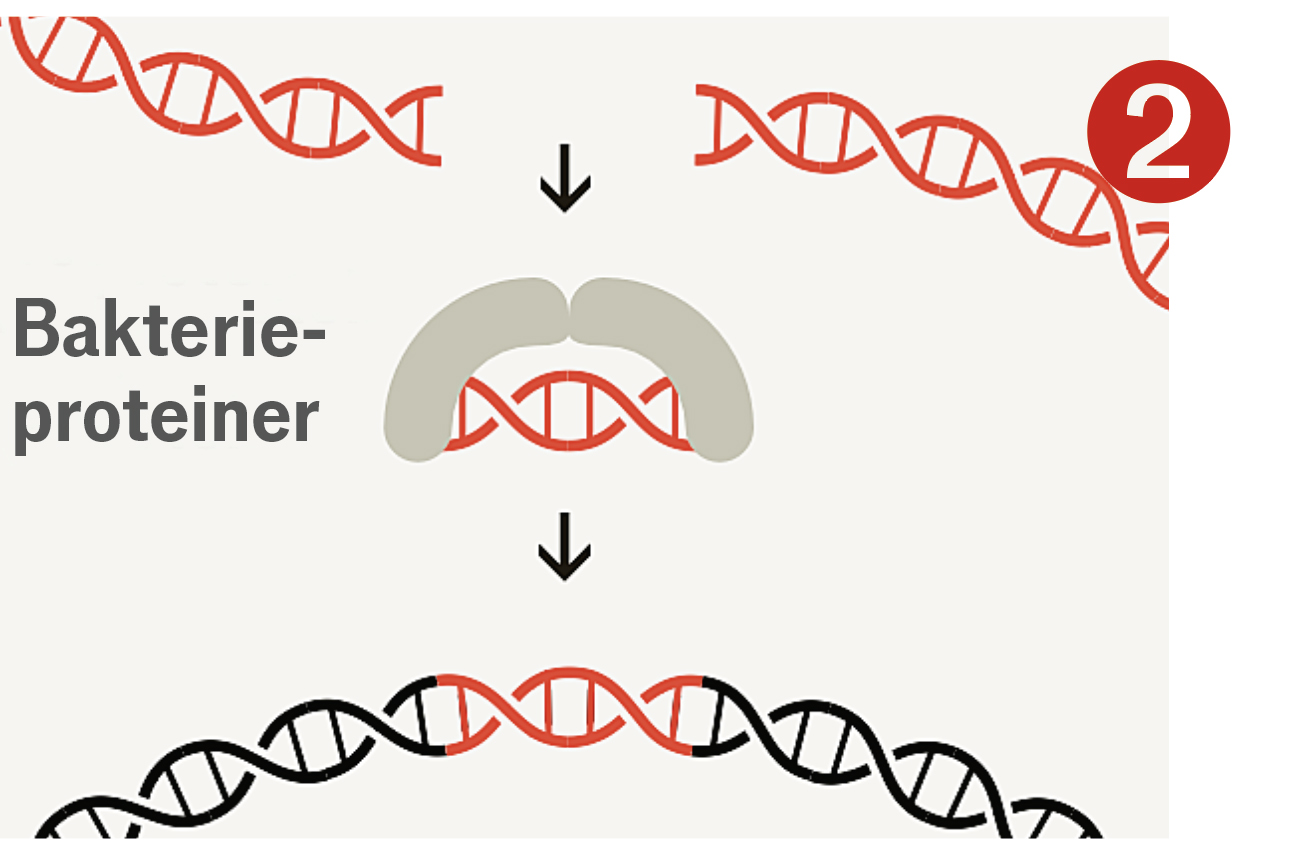
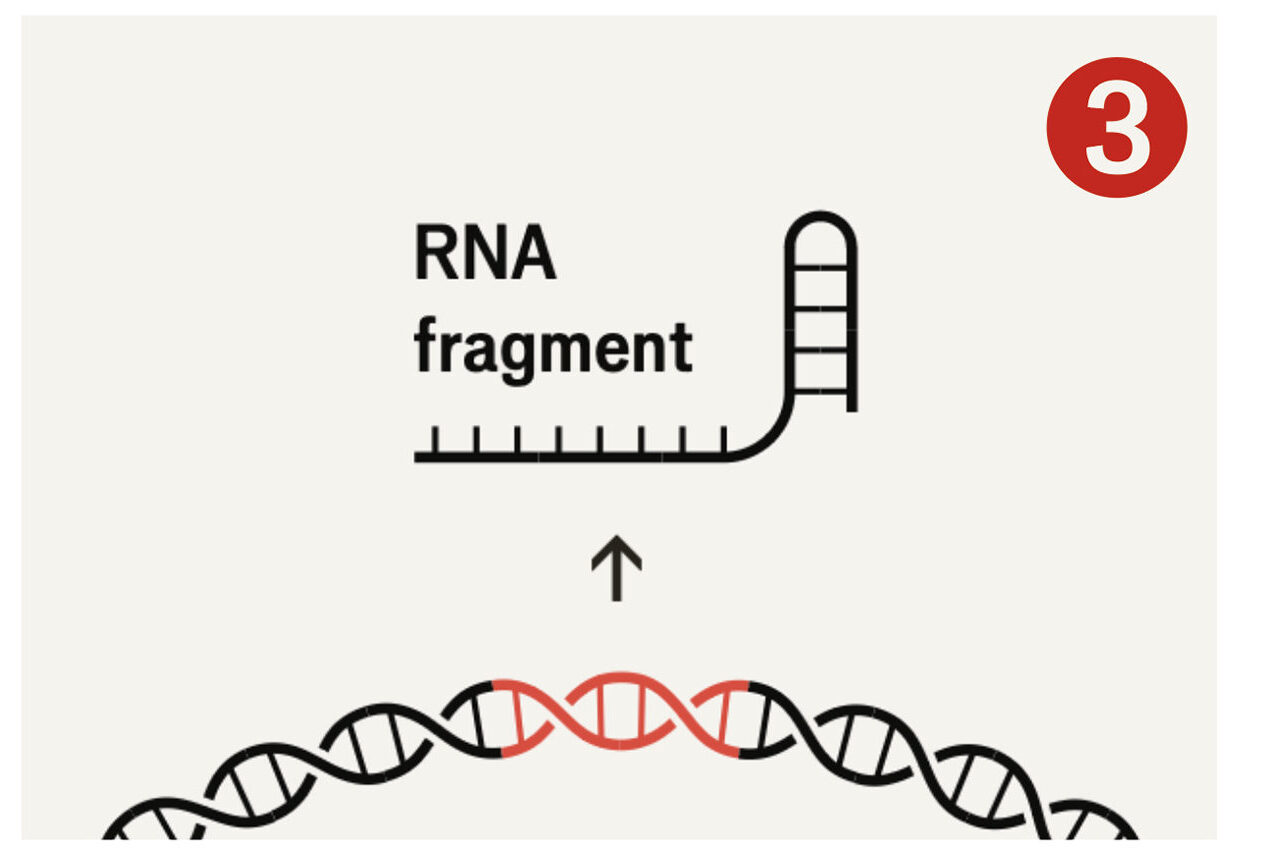
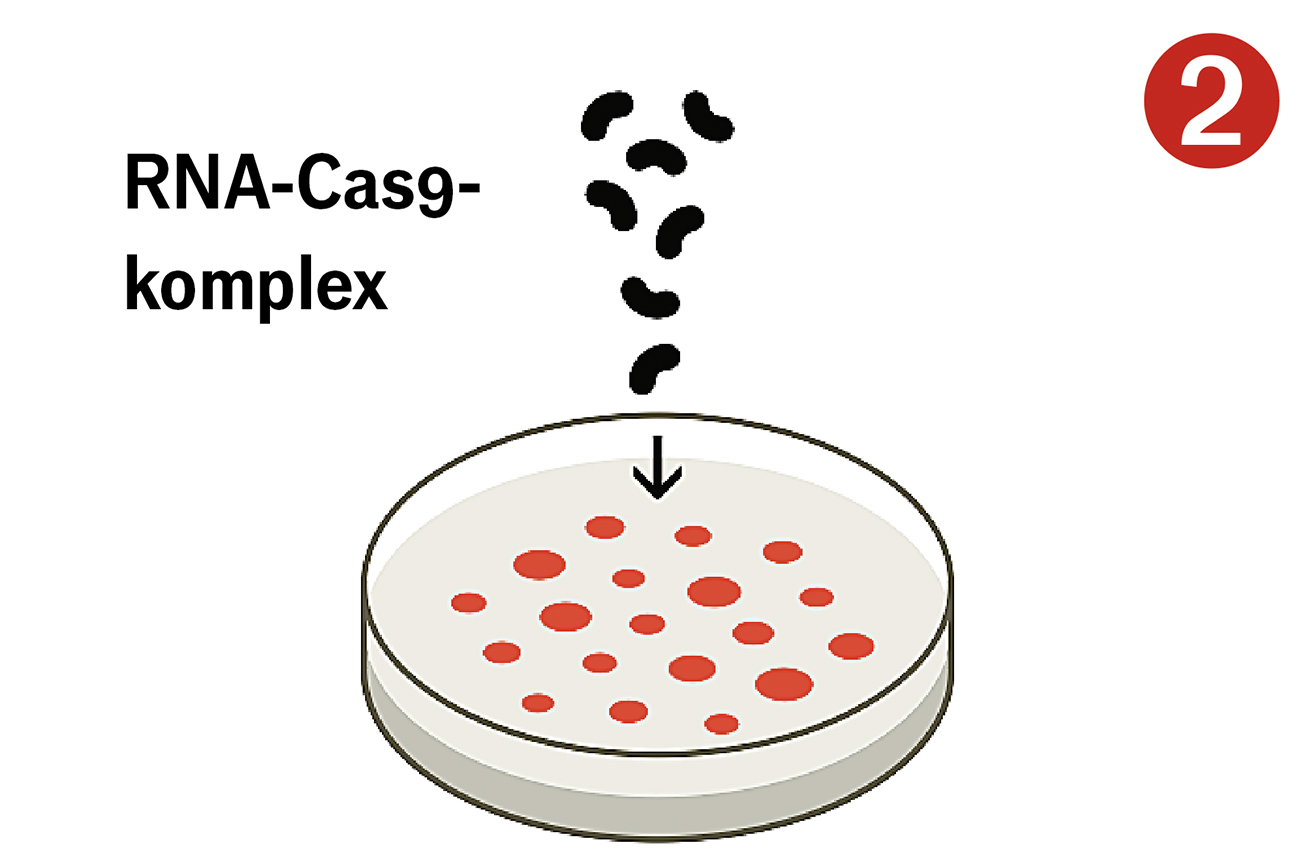
I labbet använder forskare Crispr för att anpassa gener
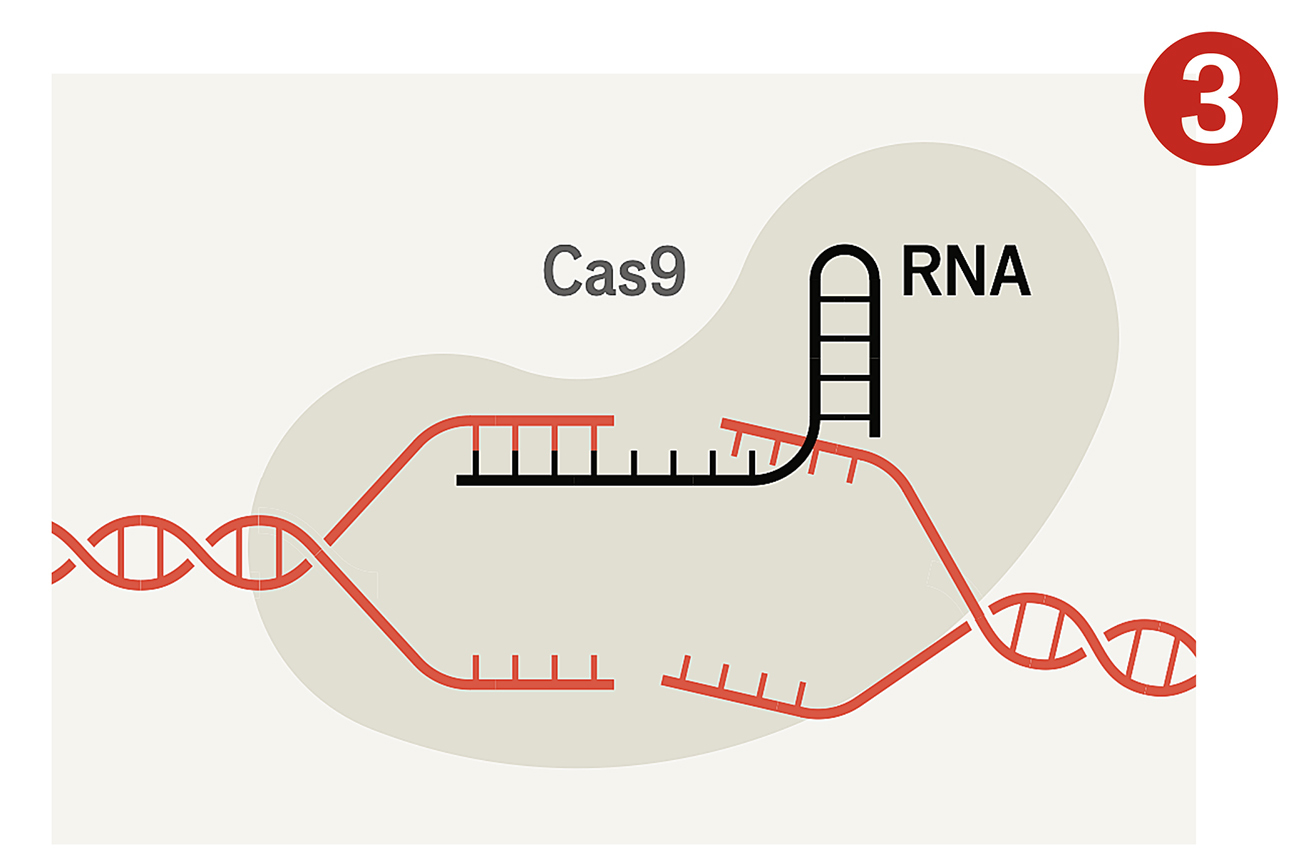
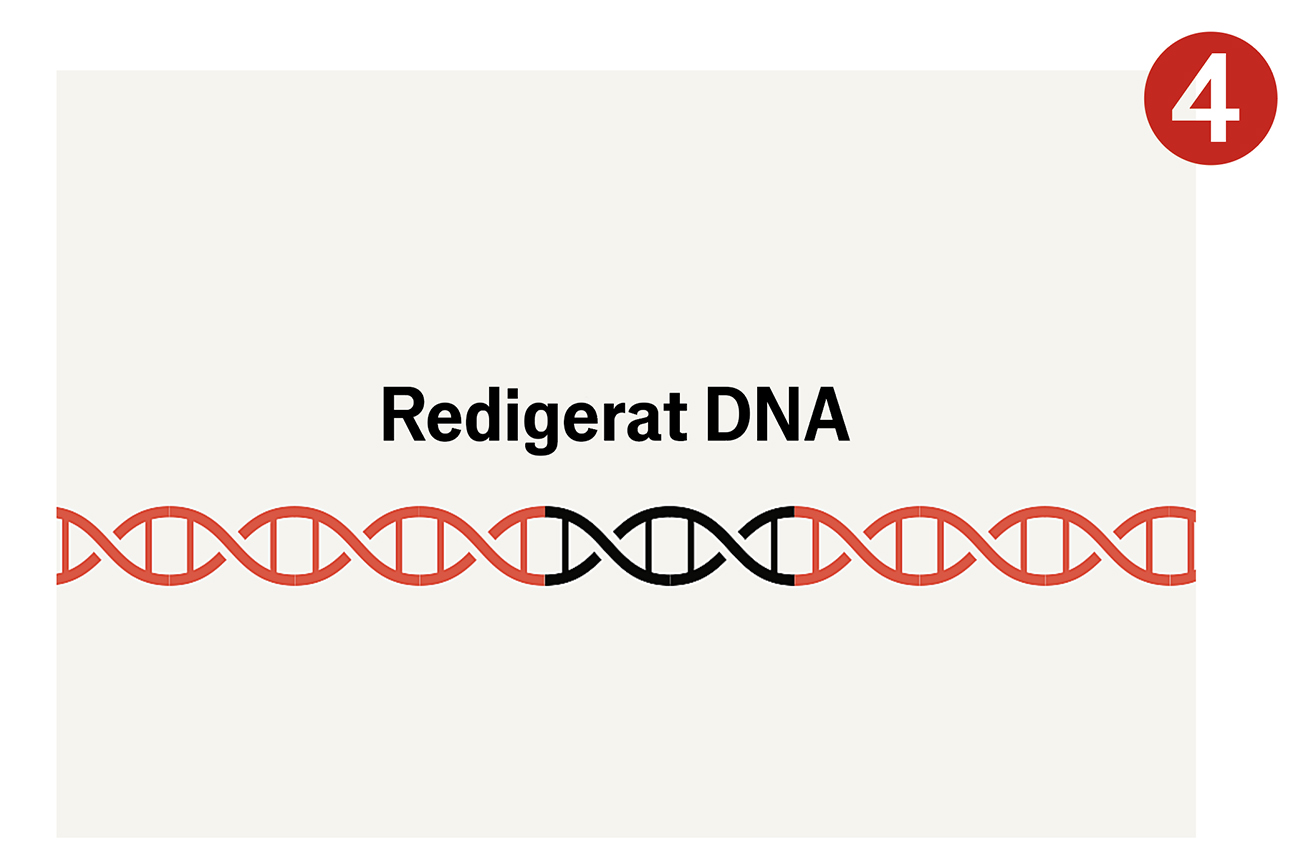
Sedan drar Crispr nytta av cellens mekanism för att reparera DNA. Eftersom celler i regel reparerar skadat DNA på ett ofullständigt sätt, blir den gen man riktat in sig på ofta ”utslagen”. Denna förmåga att slå ut gener är grunden i den första våg av Crispr-läkemedel som nu går mot klinisk prövning. Mer sofistikerad teknik för att göra precisa förändringar och föra in nya sekvenser är idag vanligt förekommande i labb, och kommer snart att nå såväl sjukvården som fröleverantörer och jordbruk.
Genmanipulering för att bota sjukdomar och förädla grödor är ingen ny idé. Men särskilt inom medicin begränsades tekniken av att den var osäker eller för komplicerad för att tillämpa. Att bygga en gensax tog månader. Med Crispr kan till och med gymnasieelever få tag i en sådan på den tid det tar att beställa RNA-sekvenser online och få dem skickade med FedEx. Läkemedelsjättarna har snabbt tagit till sig tekniken, som nu är standard i deras labb. Det har i sin tur gett upphov till bioteknikföretag och innovationer som kan visa sig än mer kraftfulla. Stater ändrar sina regleringar för att utnyttja potentialen.
Tekniken formligen skriker ”världsomvälvande”. Med Crispr kan man på nya sätt nå biologiska mål – inte bara medicinska sådana, som att bekämpa hjärtsjukdom, utan också jordbruks- och miljörelaterade mål, på sätt som förr inte ens gick att föreställa sig. Än verkar dock världen i stort opåverkad. Kommer Crispr att fastna i samma fallgropar och misslyckanden som äldre typer av samma teknik? Eller är den utlovade revolutionen nu inom räckhåll för forskarna?
Läs fler artiklar (sammanlagt sju) i The Economists TQ-rapport Gene Editing: The Age of Crispr på economist.com/technology-quarterly

Denna text publicerades ursprungligen i det tryckta magasinet Världen Om juni 2025.
Översättare: Jesper Sandström
Läs fler artiklar från samma nummer här.
Så här jobbar Världen Om med kvalitetsjournalistik: Vi väljer ut artiklar. analyser, data och intervjuer från The Economist som täcker in geopolitik, vetenskap, livsstil, affärer och kultur. The Economist har funnits sedan 1843 för att "stärka kampen för intelligent upplysning i syfte att motverka okunskap som hindrar framsteg och utveckling."