AI kan snabba på läkemedelsutvecklingen
Artificiell intelligens kan snabba på läkemedelsutvecklingen.

Artificiell intelligens kan snabba på läkemedelsutvecklingen.

Från The World Ahead 2025 publicerad i The Economist, översatt av InPress. ©2024 The Economist Newspaper Limited. Alla rättigheter förbehållna.
Abby Bertics, vetenskapskorrespondent, The Economist
Framsteg inom datorutveckling har länge beskrivits med hjälp av Moores lag, en tumregel som säger att kostnaden för processorkraft halveras ungefär vartannat år. Läkemedelsindustrin följer en motsatt regel. Där talar man om Erooms lag (”Moore” baklänges), enligt vilken kostnaden för att utveckla ett nytt läkemedel fördubblas ungefär vart nionde år. På 1960-talet gav 1 miljard dollar (i 2008 års priser) i forsknings- och utvecklingskostnader ett tiotal nya läkemedel.
I dag räcker samma miljard inte till ett enda.
I snitt krävs nu tio år och mer än 2 miljarder dollar för att utveckla ett läkemedel från början till slut. Riskerna är också stora – färre än en tiondel av de läkemedelskandidater som når klinisk prövning godkänns av tillsynsmyndigheterna. Under de senaste tio åren har det amerikanska läkemedelsverket i snitt godkänt bara 53 nya läkemedel om året. Förespråkare av artificiell intelligens menar att AI kan göra läkemedelsutvecklingen snabbare och billigare, vilket vore välkommet för såväl läkemedelsföretag som patienter. När en rad nya läkemedel närmar sig myndighetsgodkännande under 2025, kommer värdet av AI att börja märkas.
Läkemedelsutveckling börjar med att identifiera ett mål, exempelvis ett protein eller en gen, som kan kopplas till en viss sjukdom. Forskare söker sedan efter en molekyl som antingen kan blockera eller aktivera målet. När potentiella molekyler har hittats testas de för säkerhet och effektivitet, först med hjälp av datormodeller och sedan på djur. Denna fas, som kallas det prekliniska stadiet, kan innebära granskning av uppemot en miljon olika molekylföreningar, för att sedan välja ut bara en eller två lovande kandidater. Processen kan ta åratal och står för nästan en tredjedel av utvecklingskostnaderna, innan några tester på människa ens har börjat.
Det är i denna prekliniska fas som läkemedelstillverkare tar AI till hjälp. Läkemedelsindustrin har använt beräkningsmodeller i årtionden, men AI förändrar upptäcktsprocessen på flera sätt. För det första bidrar den till forskarnas förståelse av sjukdomar och deras mål genom att analysera enorma mängder olika data.
Programvara kan också peka ut lovande molekyler och finjustera deras strukturer så att de når större framgång i studier på människa. Generativ AI kan gå ett steg längre genom att tänka ut helt nya molekyler att testa.
2020 slogs forskarvärlden med häpnad av AlphaFold 2, en modell utvecklad av Googleägda AI-labbet Deepmind, när denna med precision förutspådde strukturen hos nästan samtliga protein i människokroppen. I maj 2024 utökade efterträdaren, AlphaFold 3, sina färdigheter till andra molekyler som levande varelser består av: proteiner, DNA , RNA och små molekyler som kallas ligander. Sådana modeller förändrar läkemedelsutvecklingen, när månader av experimentella försök kan ersättas av några timmars beräkningar. Insilico, en startup inom AI-baserad läkemedelsutveckling, hävdar att deras programvara identifierade ett nytt läkemedelsmål och designade en molekyl som lämpar sig för mänskliga försök på 18 månader och till en kostnad av 2,7 miljoner dollar – en bråkdel av den tid och de pengar som vanligtvis krävs.
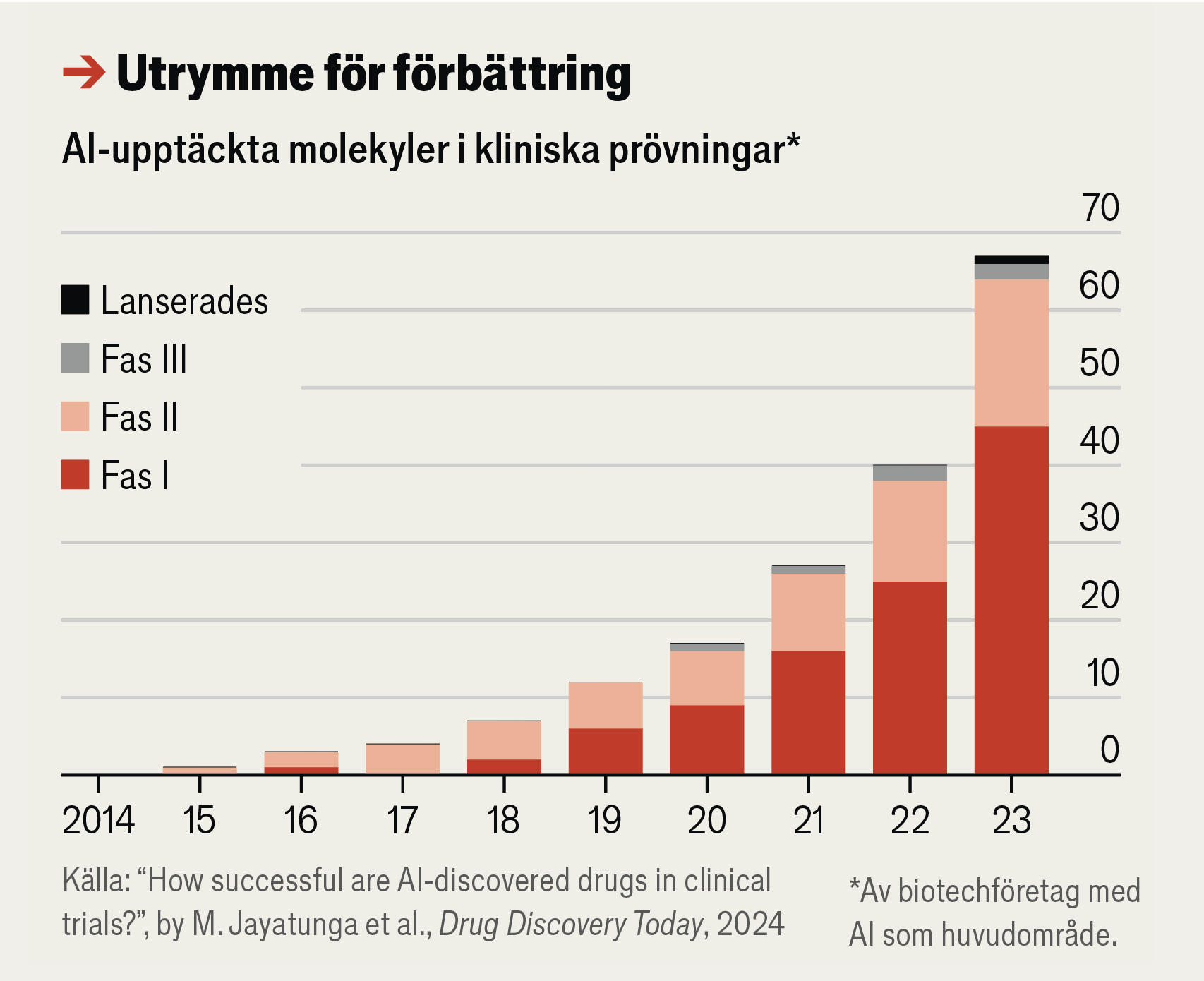
Genombrott i den prekliniska fasen har nu nått det kommersiella stadiet. Konsultföretaget BCG uppskattar att omkring 65 AI-inspirerade molekyler just nu testas på människa. Ungefär en tredjedel av dessa är i den andra fasen av klinisk prövning, där läkemedlet testas för effektivitet och biverkningar. Företagen måste sedan besluta om de ska gå vidare med dyrare fas tre-studier på en större population. Färre än en tredjedel av läkemedelskandidaterna tar det steget.
Under 2025 redovisas resultaten från denna avgörande andra fas för ett halvdussin läkemedel.
Några AI-designade läkemedel har snubblat redan på den mållinjen. Benevolent AI och Exscientia, två lovande brittiska AI-startups, rapporterade nyligen negativa resultat i kliniska prövningar för sina läkemedel riktade mot eksem och cancer. Trots dessa bakslag anser Christoph Meier vid BCG, att AI-baserade metoder skulle kunna fördubbla produktiviteten inom forskning och utveckling. Och det verkar troligt att fyra eller fem AI-utvecklade behandlingar, om inte fler, kan gå vidare till fas tre-studier 2025.
Det är ett litet urval, men dessa läkemedel antyder en omvälvande förändring inom läkemedelsutvecklingen. Även om AI ännu inte har kortat tiden för kliniska prövningar, bidrar det till att läkemedelsbolagen tar smartare beslut om vilka molekyler de ska jobba vidare med, vilket ger färre misslyckanden och lägre kostnader. Exempelvis visar forskning av Andreas Bender vid Cambridge University, att 20 procent färre misslyckanden i fas två kan spara nästan 450 miljoner dollar i utvecklingen av ett enda läkemedel. På datorområdet har Moores lag tappat stinget. Inom läkemedelsindustrin kan Erooms lag snart stå inför ett liknande öde.
Så här jobbar Världen Om med kvalitetsjournalistik: Vi väljer ut artiklar. analyser, data och intervjuer från The Economist som täcker in geopolitik, vetenskap, livsstil, affärer och kultur. The Economist har funnits sedan 1843 för att "stärka kampen för intelligent upplysning i syfte att motverka okunskap som hindrar framsteg och utveckling."